 |
|---|
 |
|---|
4月7日,2023年全國衛生健康工作會議召開,提出全面推進健康中國建設,持續深化醫藥衛生體制改革,不斷提高醫療衛生服務質量,促進中醫藥傳承創新,健全公共衛生體系,更好統籌疫情防控和經濟社會發展,進一步增強人民群眾健康獲得感,為全面建設社會主義現代化國家開好局起好步奠定堅實健康根基。
科學、精準、高效做好新冠“乙類乙管”常態化防控工作。繼續加強監測預警,加強重點人群管理和分級分層分流醫療衛生服務體系建設,加強醫療物資保障,推進老年人等人群疫苗接種,筑牢個人衛生健康第一道防線。
突出醫改重點領域和關鍵環節。加快推進公立醫院高質量發展,推進完善國家區域醫療中心運行機制、緊密型醫療聯合體運行機制、公益性為導向的公立醫院運行機制、“三醫”協同發展和治理機制。
著力提升醫療衛生服務水平。繼續推進優質醫療資源擴容下沉和均衡布局,推進國家醫學中心和國家區域醫療中心建設,全面提升醫療質量和專科水平,開展“改善就醫感受、提升患者體驗”主題活動,持續鞏固健康扶貧成果,促進鄉村醫療衛生服務體系健康發展,全面加強基層衛生健康管理,推動健全短缺藥供應保障能力。
深入開展愛國衛生運動和健康中國行動。積極倡導文明健康綠色環保的生活方式,持續開展城鄉環境衛生整治,高質量推進衛生城鎮創建和健康城鎮建設,扎實推進健康中國行動,加強慢性病管理和心理健康、精神衛生工作,深化職業病危害專項治理,提升食品安全風險監測預警和評估支撐能力。
筑牢公共衛生防護網。積極推進疾控體系改革發展,著力提升疾病預防控制能力,完善平急結合、快速反應的醫療應急體系,統籌重點傳染病防控和公共衛生工作。
持續做好重點人群健康服務。完善積極生育支持政策體系,加強老年人健康保障,不斷提高婦幼健康服務水平。
促進中醫藥傳承創新發展。深化國家中醫藥綜合改革示范區建設,加強中醫藥特色人才隊伍建設。
強化衛生健康事業發展的支撐保障。加快推動重點法律制修訂工作,系統推進衛生健康領域科研攻關,加強基層和緊缺人才隊伍培養,持續推進平安醫院建設,加大醫療行業綜合監督力度,做好正面宣傳引導,積極推進國際交流合作。
4月7日,國家藥監局藥審中心發布關于《抗腫瘤抗體偶聯藥物臨床研發技術指導原則》的通告(2023年第25號)。
抗體偶聯藥物(ADC)目前是抗腫瘤新藥研發熱點之一,尤其是在腫瘤治療領域,ADC的藥物研發持續增長。為了對ADC類抗腫瘤藥物的臨床研發中,需要特殊關注的問題提出建議,并指導企業更為科學地進行ADC的臨床研發,國家藥監局藥審中心組織制定了《抗腫瘤抗體偶聯藥物臨床研發技術指導原則》。根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,經國家藥品監督管理局審查同意,現予發布,自發布之日起施行。
4月4日,財政部社會保障司、國家衛生健康委體制改革司聯合發布了《2023年中央財政支持公立醫院改革與高質量發展示范項目競爭性評審結果公示》。
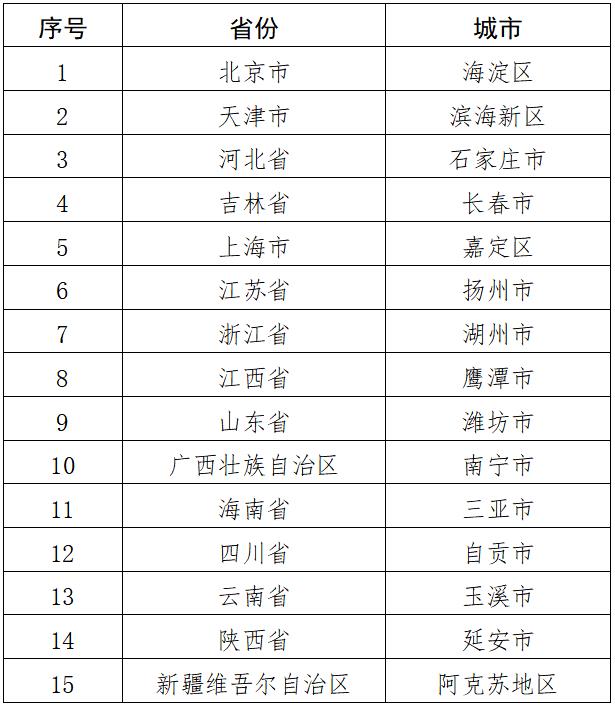
《通知》指出,中央財政支持項目通過競爭性評審方式公開擇優確定,每個項目中央財政補助5億元(其中10%的資金專門作為績效獎補資金),主要用于支持推進公立醫院改革與高質量發展。
根據文件,公立醫院改革與高質量發展示范項目主要聚焦三個方面:1.著力提升市縣級公立醫院診療能力;2.著力加強智慧醫院建設;3.著力控制醫療費用不合理增長。具體包括,支持市縣級公立醫院傳染病、精神病、急診急救、重癥醫學、心腦血管、婦產科、兒科等臨床專科建設,加強人才培養,打造一批市縣級公立醫院重點專科,做到大病重病在本省就能解決,一般病在市縣解決,緩解群眾看病難問題。
近日,CDE發布《藥審中心加快創新藥上市許可申請審評工作規范(試行)》,以鼓勵研究和創制新藥、兒童用藥、罕見病用藥創新研發進程,加快創新藥品種審評審批速度。
文件顯示,對于納入突破性治療藥物程序的創新藥,申請人應按照本工作規范要求提出溝通交流申請及上市許可申請,無需額外提出納入本工作規范的申請。如相關創新藥被取消突破性治療藥物資格,則不能再按照本工作規范開展溝通交流及審評審批工作。
對于未納入突破性治療藥物程序的兒童專用創新藥、用于治療罕見病的創新藥,申請人需按照I類會議(30日)提交溝通交流申請,經藥審中心審核同意后,可按照本工作規范開展后續溝通交流及審評審批工作。
本工作規范中的兒童專用創新藥是指,專為兒童使用而開發的1類創新藥,包括化學藥品、預防用生物制品、治療用生物制品和中藥。本工作規范中的用于治療罕見病的創新藥是指,治療發病率/患病率極低的罕見疾病的1類創新藥,包括化學藥品、預防用生物制品、治療用生物制品和中藥。
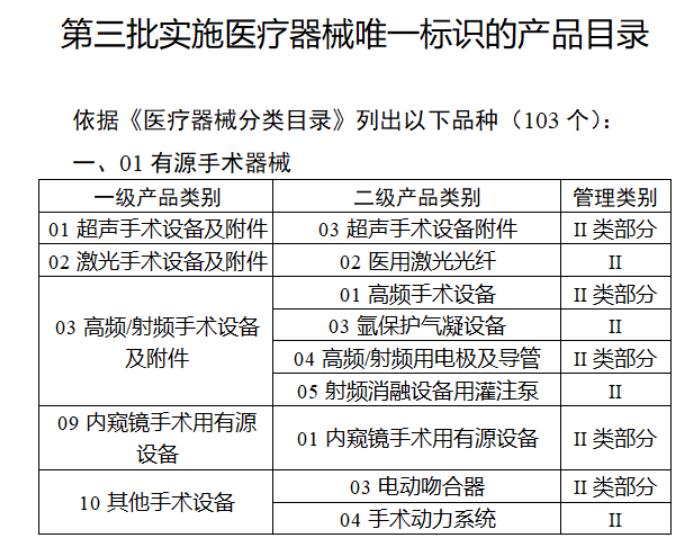
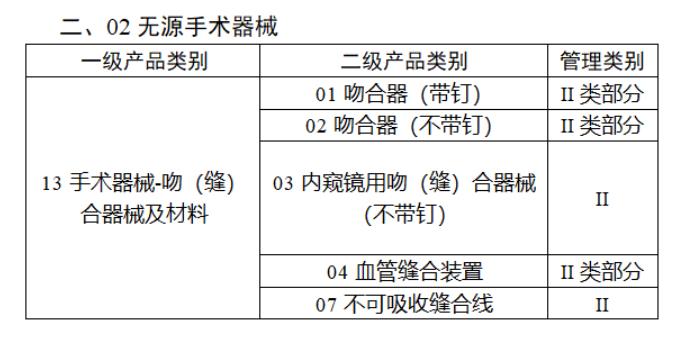
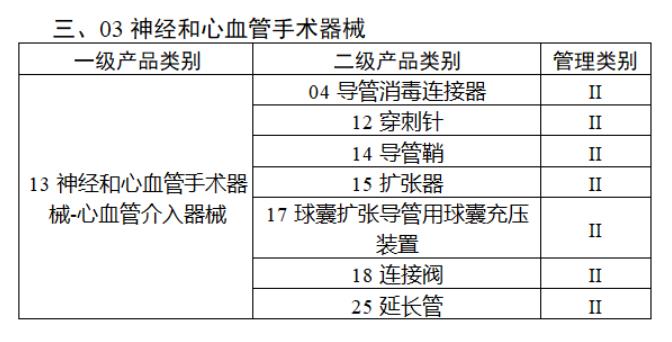
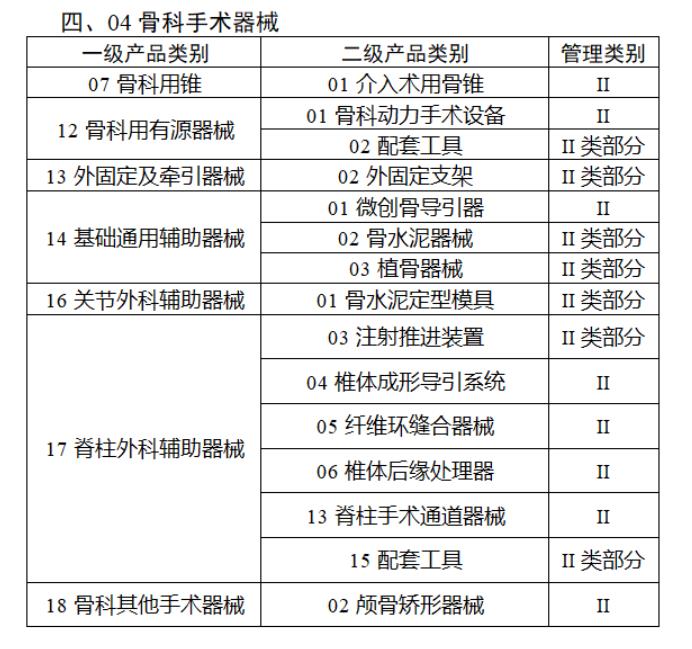
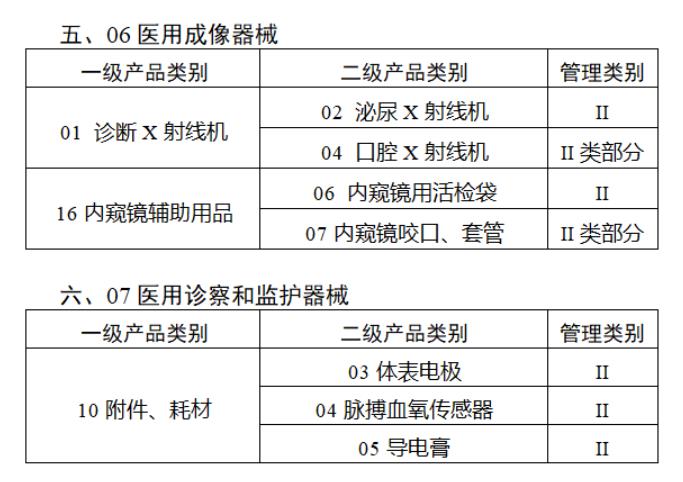
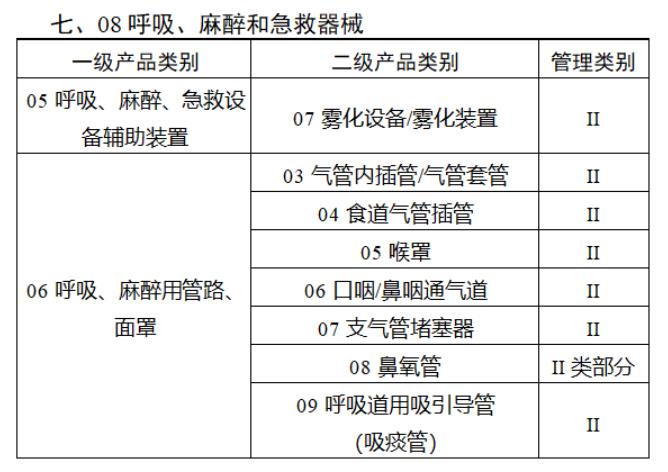
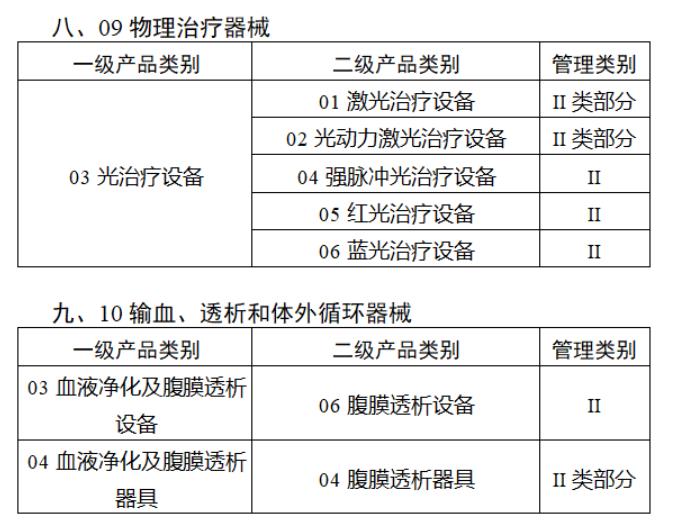
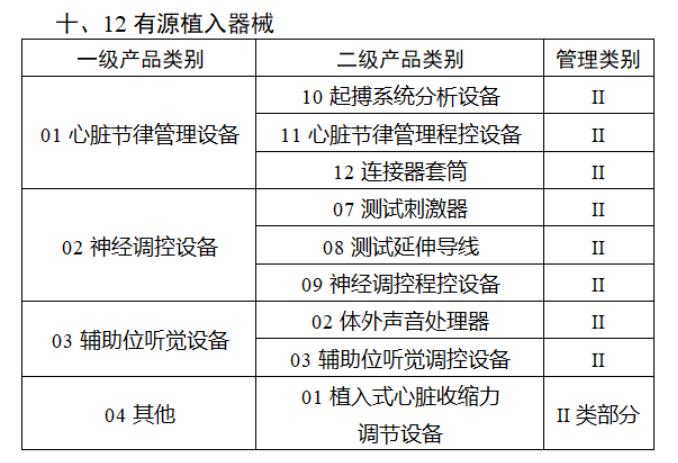
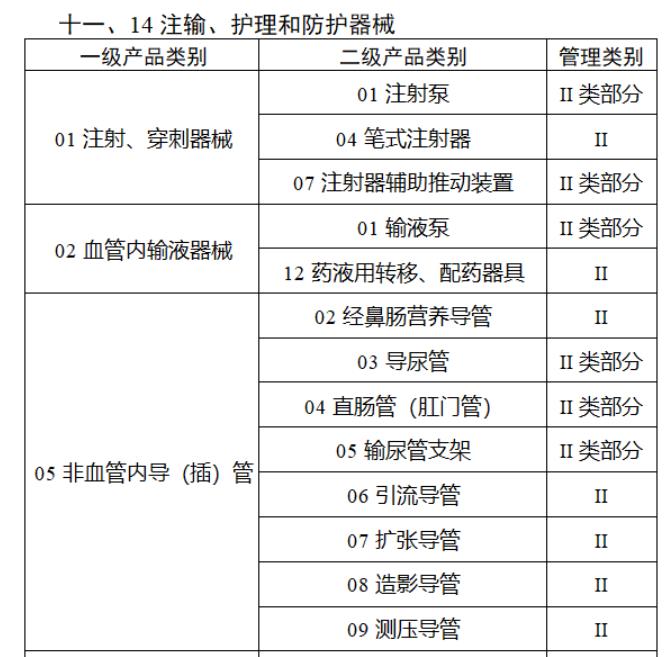
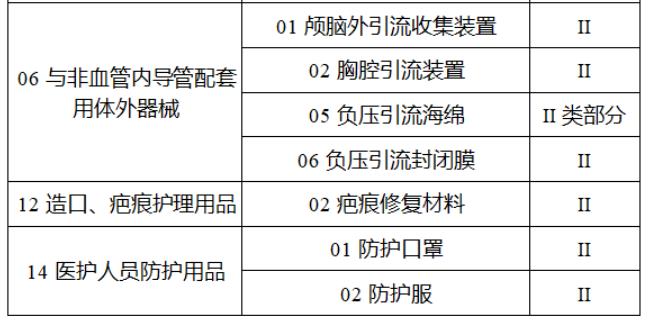
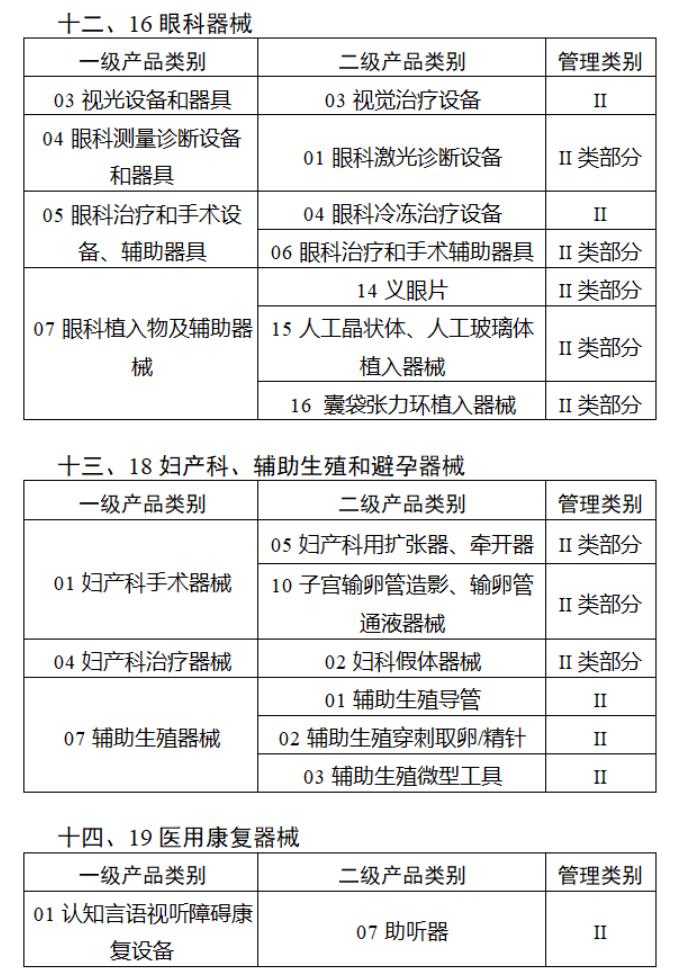
近日,北京市藥監局、北京市衛健委、北京市醫保局發布《關于做好第三批實施醫療器械唯一標識工作的通知》,北京市藥監局還制定印發了《北京市醫療器械注冊人備案人唯一標識實施指南》《北京市醫療器械經營企業唯一標識實施指南》《北京市醫療機構醫療器械唯一標識實施指南》。分別對注冊人、備案人、經營企業、醫療機構多個環節的UDI覆蓋工作提供了指導建議,執行第三批醫療器械唯一標識要求,同時鼓勵其他第二類醫療器械實施唯一標識。

聲明:本文不構成任何投資建議,且非治療治方案推薦。
點擊:閱讀轉載原文